 Studi familiari e studi su gemelli hanno dimostrato chiaramente la presenza di una forte componente genetica nella suscettibilità alla psoriasi ed alla psoriasi artropatica. La probabilità di ammalare, avendo un parente di primo grado affetto, è sicuramente più alta rispetto alla popolazione generale e in particolare il rischio di ricorrenza nei figli di un affetto è compreso tra 4 e 10. Studi su gemelli hanno riportato una concordanza del 62-70% tra gemelli monozigoti verso il 21-23% tra gemelli dizigoti. Il meccanismo di trasmissione di queste malattie sembra quindi essere multifattoriale ed il rischio di ricorrenza della psa sembra essere molto superiore rispetto a quello della pso. Attualmente si stima che il rischio di ricorrenza per un individuo con un parente di primo grado affetto sia 7.6 per la psoriasi e 30.4 per la psoriasi artropatica. Questi dati confermano la forte importanza della componente genetica nella patogenesi di queste due forme patologiche. Comprendere nello specifico quali siano le componenti genetiche che svolgono questo ruolo è complicato e richiede numerosi e complessi studi di ricerca.
Studi familiari e studi su gemelli hanno dimostrato chiaramente la presenza di una forte componente genetica nella suscettibilità alla psoriasi ed alla psoriasi artropatica. La probabilità di ammalare, avendo un parente di primo grado affetto, è sicuramente più alta rispetto alla popolazione generale e in particolare il rischio di ricorrenza nei figli di un affetto è compreso tra 4 e 10. Studi su gemelli hanno riportato una concordanza del 62-70% tra gemelli monozigoti verso il 21-23% tra gemelli dizigoti. Il meccanismo di trasmissione di queste malattie sembra quindi essere multifattoriale ed il rischio di ricorrenza della psa sembra essere molto superiore rispetto a quello della pso. Attualmente si stima che il rischio di ricorrenza per un individuo con un parente di primo grado affetto sia 7.6 per la psoriasi e 30.4 per la psoriasi artropatica. Questi dati confermano la forte importanza della componente genetica nella patogenesi di queste due forme patologiche. Comprendere nello specifico quali siano le componenti genetiche che svolgono questo ruolo è complicato e richiede numerosi e complessi studi di ricerca.
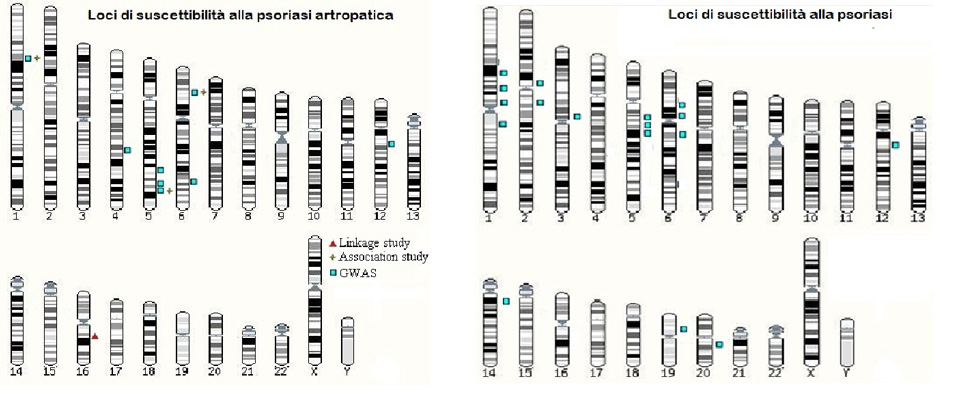
Nel corso degli anni diversi gruppi di ricerca nel mondo hanno concentrato le loro attenzioni sulla psoriasi ed hanno portato ad evidenziare diversi loci di suscettibilità (PSORS - psoriasis susceptibility locus), ovvero punti nel DNA in grado di influenzare direttamente o indirettamente lo sviluppo della malattia. Tra i loci associati alla psoriasi ritroviamo PSORS1 sul braccio corto del cromosoma 6 (6p21.3), PSORS2 sul braccio lungo del cromosoma 17 (17q), PSORS4 sul braccio lungo del cromosoma 1 (1q21.3), PSORS5 sul braccio lungo del cromosoma 3 (3q21), PSORS6 sul braccio corto del cromosoma 19 (19p), PSORS7 sul braccio corto del cromosoma 1 (1p), PSORS8 sul braccio lungo del cromosoma 16 (16q), PSORS9 sul braccio lungo del cromosoma 4 (4q28-32) e PSORS10 sul braccio corto del cromosoma 18 (18p11). La presenza di tutti questi loci indica l’enorme studio alla base della loro individuazione, ma andando ad indagare il peso di ognuno di essi vedremo come la loro influenza sul rischio di sviluppare la psoriasi è molto bassa, il che ci porta a dedurre che il ruolo della genetica è composto da un numero molto elevato di varianti che però, prese singolarmente, hanno un effetto minimo. Tale particolare scenario genetico alla base della psoriasi non permette la formulazione di un test genetico valido per la definizione del rischio individuale.
Relativamente alla psoriasi artropatica, molto meno è stato identificato relativamente alle basi genetiche della patologia. In comune tra psoriasi e artropatia psoriasica è stata individuata l’associazione al locus PSORS1, che localizza nel cromosoma 6, in corrispondenza della regione che codifica per il sistema maggiore di istocompatibilità. In tale regione sono contenuti alcuni tra i geni più importanti per la risposta immunitaria. Le prime evidenze di associazione tra la psoriasi e il sistema HLA risalgono agli anni ’70 e sono state poi confermate in seguito grazie all’introduzione di nuove tecnologie di analisi. I primi geni identificati in associazione sono stati l’HLA-C, in particolar modo l’ HLA-Cw6, e l’HLA-B. Si è poi scoperto che l’associazione con l’HLA-B era semplicemente dovuta a linkage disequilibrium con l’HLA-C. Il linkage disequilibrium è la tendenza di alcune varianti genetiche ad essere ereditate insieme. Associazioni significative sono state rilevate anche con la psoriasi artopatica. In particolare, mentre gli HLA-B*13, *16, *38, *39, *17 e l’HLA-Cw6 possono avere un effetto sullo sviluppo della psoriasi (con o senza artropatia), gli HLA-B*27 e *7 sono specificamente associati alla psoriasi artropatica, e soprattutto a quelle forme in cui la componente psoriasica ha un esordio precoce.
 Finora sono stati condotti grandi passi avanti nella comprensione dei meccanismi alla base di psoriasi e psoriasi artropatica, molti fattori genetici ed ambientali sono stati identificati ed oggi il trattamento medico può tenere in considerazione un elevato numero di fattori ambientali. Per quanto riguarda invece i fattori genetici, come si è visto, poco è stato identificato, sebbene gli studi siano stati numerosissimi. I loci finora identificati spiegano solo una piccola frazione dell’ereditabilità stimata, quindi solo una piccola parte del rischio individuale determinato dal fatto di avere un parente di primo grado affetto può essere giustificata in base alla presenza/assenza di loci di suscettibilità/protezione. Nel prossimo futuro, l’avanzamento della ricerca e l’introduzione di nuove tecnologie in grado di studiare non solo le varianti genomiche, ma anche quelle epigenomiche, permetteranno di identificare nuovi fattori e di chiarire il ruolo specifico di quelli già noti. L’avanzamento della ricerca nell’ambito della psoriasi e della psoriasi artropatica migliorerà le conoscenze sulla patogenesi di queste malattie ed aiuterà a predire l’esordio e la progressione, così come la risposta individuale ai farmaci. In tal senso si potranno sviluppare specifici programmi di medicina personalizzata, basandosi su informazioni facilmente reperibili dal paziente (come il DNA e i fattori ambientali ai quali è esposto).
Finora sono stati condotti grandi passi avanti nella comprensione dei meccanismi alla base di psoriasi e psoriasi artropatica, molti fattori genetici ed ambientali sono stati identificati ed oggi il trattamento medico può tenere in considerazione un elevato numero di fattori ambientali. Per quanto riguarda invece i fattori genetici, come si è visto, poco è stato identificato, sebbene gli studi siano stati numerosissimi. I loci finora identificati spiegano solo una piccola frazione dell’ereditabilità stimata, quindi solo una piccola parte del rischio individuale determinato dal fatto di avere un parente di primo grado affetto può essere giustificata in base alla presenza/assenza di loci di suscettibilità/protezione. Nel prossimo futuro, l’avanzamento della ricerca e l’introduzione di nuove tecnologie in grado di studiare non solo le varianti genomiche, ma anche quelle epigenomiche, permetteranno di identificare nuovi fattori e di chiarire il ruolo specifico di quelli già noti. L’avanzamento della ricerca nell’ambito della psoriasi e della psoriasi artropatica migliorerà le conoscenze sulla patogenesi di queste malattie ed aiuterà a predire l’esordio e la progressione, così come la risposta individuale ai farmaci. In tal senso si potranno sviluppare specifici programmi di medicina personalizzata, basandosi su informazioni facilmente reperibili dal paziente (come il DNA e i fattori ambientali ai quali è esposto).
IL SUPPORTO DELL’ADIPSO ALLA RICERCA GENETICA
L’ADIPSO ha da sempre creduto nella ricerca genomica e nelle potenzialità della genetica quale strumento per la prevenzione e la cura della psoriasi. Negli anni il supporto dell’ADIPSO al gruppo di ricerca del prof. Giusepe Novelli dell’Università di Tor Vergata ha consentito lo svolgimento di importanti studi genetici volti alla comprensione delle basi molecolari della malattia. In particolare è stato per la prima volta scoperto che la regione chiamata 1q21 sul cromosoma 1 contiene geni importantissimi per lo sviluppo della malattia. In particolare è stato osservato che questa regione è determinante specialmente nei pazienti Italiani, gettando le basi per la medicina genomica personalizzata. Successivi studi, sempre finanziati dall’ADIPSO hanno identificato i geni di suscettibilità della psoriasi localizzati su questo cromosoma. Grandi risultati sono stati ottenuti anche per la valutazione della componente genetica della psoriasi artropatica. In particolare sono stati identificati tutti i principali geni coinvolti mediante uno studio mastodontico che ha visto la partecipazione di tutti i più importanti gruppi di ricerca del mondo attivi su questo argomento. L’Italia ha partecipato grazie all’aiuto della ADIPSO.
I ricercatori, alla fine degli anni '70, attraverso studi casuali su determinati farmaci sistemici per la cura della psoriasi, hanno dimostrato che la psoriasi è una malattia immuno-mediata, che coinvolge quindi il sistema immunitario. Esso ci difende da tutti quei corpi estranei, i quali entra
e del sistema immunitario, nel meccanismo della psoriasi, avviene attraverso il meccanismo dell'immunità cellulo-mediata, che coinvolge fondamentalmente due tipi di cellule: i linfociti T e le cellule APC, cellule che presentano l'antigene.
I linfociti T sono cellule "sentinella" che alla presenza di un antigene reagiscono attaccandolo e distruggendolo.Quest'azione viene mediata dalle APC, cellule specializzate che "catturano" gli antigeni e li "presentano" ai linfociti in modo che questi possano distruggerli.
Il processo immunitario prevede tre fasi:
- I linfociti T, che alla nascita non riconoscono alcun tipo di antigene, hanno bisogno di essere "addestrati" e le cellule APC sono preposte a farlo. La struttura esterna del linfocita cambia in modo tale che da quel momento in poi riconoscerà specificatamente quell'antigene.
- Una volta "addestrati", i linfociti T migrano nel sangue e attraverso i vasi si spostano in tutti i settori del corpo.
- Giunti nelle porzioni periferiche del nostro organismo, i linfociti T danno attivamente la caccia agli antigeni. Nel caso in cui incontrino quello per cui sono stati addestrati, reagiscono producendo copie di se stessi, attaccando l'intruso ed eliminandolo.
Nella psoriasi i linfociti, una volta nel sangue, escono dai vasi, si dirigono nella pelle e incontrando nuovamente l'antigene, si attivano e reagiscono producendo citochine.
A contatto dell'epidermide, le citochine ne aumentano la velocità di divisione fino a sette volte, mentre nel derma provocano un'infiammazione.
La crescita a dismisura degli strati inferiori della pelle fa in modo che le cellule degli strati superiori non abbiano il tempo di maturare completamente.
Il risultato finale è l'accumularsi di strati sempre più spessi di cellule, che risultano nella formazione di una placca.
La ricerca attuale è orientata verso la produzione di molecole proteiche ottenute con la tecnica del DNA ricombinante.
Come funziona la sperimentazione clinica
Prima di poter essere messi in commercio, tutti i nuovi farmaci devono superare una lunga fase di sperimentazione. In generale si parla di sperimentazione clinica di un farmaco quando si vuole valutare l'efficacia /o la tollerabilità e/o la sicurezza di un trattamento farmacologico sull'uomo.
La sperimentazione clinica comporta un iter lungo e costoso, le cui diverse fasi sono descritte e stabilite dalla legge in modo da garantire procedure etiche e in grado di minimizzare i rischi per i pazienti.
Per indicare le sperimentazioni cliniche si usa spesso il termine più "italianizzato" trials clinici.
Dove avviene la sperimentazione dei nuovi farmaci
Le Sperimentazioni cliniche vengono in genere effettuate nelle strutture ospedaliere/ universitarie pubbliche o private autorizzate.
L'azienda o l'istituzione che finanzia lo studio è detta sponsor.
Gli sponsor degli studi clinici sono quasi sempre le industrie farmaceutiche, interessate a sviluppare nuovi farmaci in vista della loro commercializzazione. Per questo investono somme ingenti, dato che gli studi clinici sono sempre lunghi e costosi.
Una parte minore di studi clinici è invece finanziata da organismi di ricerca pubblici.
Uno studio è detto multicentrico quando coinvolge più istituti o centri di ricerca.
Lo studio clinico controllato
Negli studi clinici controllati un gruppo di pazienti riceve il trattamento sperimentale, mentre un altro gruppo - il gruppo di "controllo" - riceve una terapia standard ( ad esempio un farmaco già utilizzato per la stessa patologia), oppure (dove sia eticamente/clinicamente accettabile) un placebo, cioè una preparazione apparentemente identica a quella che si vuole testare ma che non contiene alcun principio attivo. L'efficacia del nuovo farmaco viene così confrontata con quella della terapia standard o del placebo.
In uno studio controllato randomizzato (dall'inglese "randomized" -cioè scelti a caso) i pazienti sono assegnati a caso al gruppo sperimentale o a quello di controllo, invece di essere scelti in modo deliberato dai ricercatori.
Gli studi in cieco e in doppio cieco
Uno studio randomizzato si dice in cieco (in inglese blind) quando i pazienti non sanno a quale gruppo sono stati assegnati.
Ovviamente prima di partecipare ad uno studio in cieco i pazienti devono essere messi al corrente della possibilità che non venga loro somministrato il farmaco sperimentale ma il placebo.
In uno studio in doppio cieco (double blind in inglese), né i pazienti né i medici sanno chi sta assumendo la cura sperimentale e chi il placebo. Le etichette dei farmaci e dei placebo portano dei codici, che vengono svelati solo alla fine dell'esperimento, o in caso di necessità.
In uno studio in doppio cieco l'efficacia della terapia farmacologica viene valutata facendo il confronto tra i dati ottenuti nei pazienti trattati con il farmaco e in pazienti trattati con il placebo. Solo se c'è una differenza statisticamente significativa tra i due tipi di "trattamento" a favore del gruppo di pazienti che è stato trattato con il farmaco si può dire che quest'ultimo ha un'efficacia terapeutica.
Le diverse fasi della sperimentazione clinica
Non è sempre facile tracciare divisioni nette fra le diverse fasi della sperimentazione clinica, dato che a seconda del prodotto esaminato o della metodologia di studio alcune fasi si possono sovrapporre. Tipicamente, la sperimentazione avviene in 4 fasi, al termine di ognuna di esse i risultati determineranno se il farmaco sarà adatto ad entrare nelle fasi successive o se invece la sperimentazione verrà interrotta.
Fase I
Studio preliminare sulla sicurezza e sulla modalità di azione
Lo scopo principale di questa prima fase non è quello di valutare l'efficacia del nuovo farmaco, ma quello di dare una prima valutazione sulla sua sicurezza e allo stesso tempo di determinare quello che accade al farmaco nel corpo umano: come viene assorbito, metabolizzato ed escreto.
Lo studio è effettuato in generale su un piccolo numero di volontari sani. La fase I può anche servire ad evidenziare eventuali effetti indesiderati della sostanza in funzione del dosaggio.
Per passare alle fasi successive un farmaco deve dimostrare di non essere tossico, o perlomeno di avere una tossicità accettabile rispetto all'uso previsto.
Fase II
Studi terapeutici pilota
Lo scopo principale è quello di valutare l'efficacia del farmaco ( ad un preciso dosaggio e con una definita posologia) in un ristretto numero di pazienti affetti dalla malattia o dalla condizione clinica per la quale il farmaco è proposto.
Fase III
Studi terapeutici su più larga scala
Se la fase II fornisce risultati incoraggianti la fase III coinvolge un numero più ampio di pazienti al fine di approfondire i dati di efficacia, di valutare il dosaggio più opportuno, di monitorare gli eventuali effetti collaterali su un campione statisticamente più significativo.
Per la maggior parte, gli studi di fase III sono di tipo randomizzato e in doppio cieco e la loro durata è variabile a seconda degli obiettivi che la sperimentazione stessa si pone. Durante questa fase viene sempre controllata con molta attenzione la tollerabilità (insorgenza di effetti indesiderati e/o collaterali) del farmaco.
I farmaci che passano con successo la fase III della sperimentazione ottengono l'autorizzazione per la commercializzazione.
Fase IV
Dopo la commercializzazione
Anche quando un farmaco viene venduto ed utilizzato da migliaia di persone in uno o più paesi gli studi clinici continuano con la fase IV.
Gli studi di fase IV sono volti a confermare la sicurezza e la tollerabilità a lungo termine del farmaco, su un ampio numero di pazienti.
I dati che si ottengono sono statisticamente importanti, dato che coinvolge un gran numero di utilizzatori, spesso diversi per età, razza, sesso etc…
Le autorità che vigilano sui Trials Clinici
La sperimentazione clinica è posta sotto il controllo delle autorità sanitarie pubbliche (Istituto Superiore di Sanità, Ministero della Sanità, Comitati Etici regionali, Comitati Etici locali) e regolamentata da leggi precise.
Per quanto riguarda i paesi dell'UE, è l'EMEA che ha lo scopo di coordinare e armonizzare le procedure in tutti i paesi dell'Unione Europea.
Negli Stati Uniti l'autorità competente è la FDA (Food and Drug Administration).
Le autorizzazioni necessarie per la sperimentazione clinica
E' interessante sapere che di tutte le nuove molecole potenzialmente utili, solo 1 su 40.000 diventerà effettivamente un farmaco.
 Studi familiari e studi su gemelli hanno dimostrato chiaramente la presenza di una forte componente genetica nella suscettibilità alla psoriasi ed alla psoriasi artropatica. La probabilità di ammalare, avendo un parente di primo grado affetto, è sicuramente più alta rispetto alla popolazione generale e in particolare il rischio di ricorrenza nei figli di un affetto è compreso tra 4 e 10. Studi su gemelli hanno riportato una concordanza del 62-70% tra gemelli monozigoti verso il 21-23% tra gemelli dizigoti. Il meccanismo di trasmissione di queste malattie sembra quindi essere multifattoriale ed il rischio di ricorrenza della psa sembra essere molto superiore rispetto a quello della pso. Attualmente si stima che il rischio di ricorrenza per un individuo con un parente di primo grado affetto sia 7.6 per la psoriasi e 30.4 per la psoriasi artropatica. Questi dati confermano la forte importanza della componente genetica nella patogenesi di queste due forme patologiche. Comprendere nello specifico quali siano le componenti genetiche che svolgono questo ruolo è complicato e richiede numerosi e complessi studi di ricerca.
Studi familiari e studi su gemelli hanno dimostrato chiaramente la presenza di una forte componente genetica nella suscettibilità alla psoriasi ed alla psoriasi artropatica. La probabilità di ammalare, avendo un parente di primo grado affetto, è sicuramente più alta rispetto alla popolazione generale e in particolare il rischio di ricorrenza nei figli di un affetto è compreso tra 4 e 10. Studi su gemelli hanno riportato una concordanza del 62-70% tra gemelli monozigoti verso il 21-23% tra gemelli dizigoti. Il meccanismo di trasmissione di queste malattie sembra quindi essere multifattoriale ed il rischio di ricorrenza della psa sembra essere molto superiore rispetto a quello della pso. Attualmente si stima che il rischio di ricorrenza per un individuo con un parente di primo grado affetto sia 7.6 per la psoriasi e 30.4 per la psoriasi artropatica. Questi dati confermano la forte importanza della componente genetica nella patogenesi di queste due forme patologiche. Comprendere nello specifico quali siano le componenti genetiche che svolgono questo ruolo è complicato e richiede numerosi e complessi studi di ricerca. Finora sono stati condotti grandi passi avanti nella comprensione dei meccanismi alla base di psoriasi e psoriasi artropatica, molti fattori genetici ed ambientali sono stati identificati ed oggi il trattamento medico può tenere in considerazione un elevato numero di fattori ambientali. Per quanto riguarda invece i fattori genetici, come si è visto, poco è stato identificato, sebbene gli studi siano stati numerosissimi. I loci finora identificati spiegano solo una piccola frazione dell’ereditabilità stimata, quindi solo una piccola parte del rischio individuale determinato dal fatto di avere un parente di primo grado affetto può essere giustificata in base alla presenza/assenza di loci di suscettibilità/protezione. Nel prossimo futuro, l’avanzamento della ricerca e l’introduzione di nuove tecnologie in grado di studiare non solo le varianti genomiche, ma anche quelle epigenomiche, permetteranno di identificare nuovi fattori e di chiarire il ruolo specifico di quelli già noti. L’avanzamento della ricerca nell’ambito della psoriasi e della psoriasi artropatica migliorerà le conoscenze sulla patogenesi di queste malattie ed aiuterà a predire l’esordio e la progressione, così come la risposta individuale ai farmaci. In tal senso si potranno sviluppare specifici programmi di medicina personalizzata, basandosi su informazioni facilmente reperibili dal paziente (come il DNA e i fattori ambientali ai quali è esposto).
Finora sono stati condotti grandi passi avanti nella comprensione dei meccanismi alla base di psoriasi e psoriasi artropatica, molti fattori genetici ed ambientali sono stati identificati ed oggi il trattamento medico può tenere in considerazione un elevato numero di fattori ambientali. Per quanto riguarda invece i fattori genetici, come si è visto, poco è stato identificato, sebbene gli studi siano stati numerosissimi. I loci finora identificati spiegano solo una piccola frazione dell’ereditabilità stimata, quindi solo una piccola parte del rischio individuale determinato dal fatto di avere un parente di primo grado affetto può essere giustificata in base alla presenza/assenza di loci di suscettibilità/protezione. Nel prossimo futuro, l’avanzamento della ricerca e l’introduzione di nuove tecnologie in grado di studiare non solo le varianti genomiche, ma anche quelle epigenomiche, permetteranno di identificare nuovi fattori e di chiarire il ruolo specifico di quelli già noti. L’avanzamento della ricerca nell’ambito della psoriasi e della psoriasi artropatica migliorerà le conoscenze sulla patogenesi di queste malattie ed aiuterà a predire l’esordio e la progressione, così come la risposta individuale ai farmaci. In tal senso si potranno sviluppare specifici programmi di medicina personalizzata, basandosi su informazioni facilmente reperibili dal paziente (come il DNA e i fattori ambientali ai quali è esposto).


